Оглавление
Доклад №2
Можно часто услышать жалобы на жесткую воду и проблемы с ней связанные. Что же такое «жесткая вода»? Какие проблемы она несет? Как смягчить воду?
Жёсткость воды — свойства воды, связанные с содержанием в ней солей жесткости. При большом количестве солей щёлочноземельных металлов в воде она называется жесткой (название произошло от того, что после стирки в такой воде ткань более жесткая). Показатель жесткости воды различен и изменяется в течение года, для его контролирования в России установлен специальный стандарт.
Жесткая вода приносит человеку много неприятностей. В ней плохо пенится мыло, она губительно действует на кожу, создает накипь на стенках котлов, чайников, труб, способствует образованию камней в мочевом пузыре и почках.
Существует несколько способов борьбы с жесткой водой, но все они имеют свои плюсы и минусы.
Термический. При кипячении воды гидрокарбонаты магния и кальция разлагаются.
- Временное смягчение воды
- Выгодно применять в домашних условиях
- Отсутствие специального оборудования
- Образуется накипь.
Реагентное умягчение. В воду добавляются реагенты: кальцинированная сода, гашеная известь или ортофосфат натрия, в итоге соли жесткости выпадают в осадок.
Смягчение воды
- Невыгодность способа в домашних условиях
- Необходимость в реагентах
- Необходимость отделения осадка.
Катионирование. В воду помещают ионообменную гранулированную загрузку, которая поглощает катионы солей щёлочноземельных металлов и отдает ионы натрия и водорода.
Смягчение воды
- Невыгодность способа в домашних условиях
- Сложность способа.
Обратный осмос. Вода проходит через полупроницаемые мембраны, которые удаляют из жидкости практически все соли.
Большая эффективность (99,9%)
- Вода очищается от всех солей, а не только от солей жесткости
- Высокая стоимость, частая смена мембран
- Невыгодность способа в домашних условиях
- Предварительная подготовка воды.
Электродиализ. Такой процесс смягчения воды имеет большое сходство с обратным осмосом, но проходит под воздействием электрического поля.
- Большая эффективность
- Редкая смена мембран
- Отсутствие предварительной подготовки воды.
- Вода очищается от всех солей, а не только от солей жесткости
- Невыгодность способа в домашних условиях
Дистилляция. Воду нагревают, она испаряется, охлаждается и конденсируется.
- Большая эффективность
- Можно применять в небольших объемах (домашних условиях)
- Вода становится дистиллированной
Жесткая вода часто причиняет неудобства человеку, но существует множество способов, помогающих избавиться от излишней жесткости воды. Все методы имеют свои недостатки и преимущества, и каждый выбирает себе тот, который ему подходит.
9 класс
Другие методы
Метод электродиализа основан на явлении направленного движения ионов электролита к электродам, подключенным к сети постоянного тока. Таким образом, ионы металлов, обуславливающие жесткость воды, задерживаются у электродов и отделяются от воды, выходящей из аппарата водоочистки.
Магнитно-ионизационный метод также использует явление направленного движения ионов, но уже под действием магнитного поля. Для увеличения в воде количества ионов ее предварительно облучают ионизирующим излучением.
Магнитная обработка воды заключается в пропускании воды через систему магнитных полей противоположной направленности. В результате этого происходит уменьшение степени гидратации растворенных веществ и их объединение в более крупные частицы, которые выпадают в осадок.
Ультразвуковая обработка воды также приводит к образованию более крупных частиц растворенных веществ с образованием осадка.Ионообменный способ и обратноосмотические процессы целесообразно подробно рассмотреть во второй части статьи, которую мы опубликуем в нашем журнале в следующем номере.
Просмотрено: 17 302
Как смягчить жесткую воду в домашних условиях из скважины или колодца
Для умягчения воды из скважин и колодцев применяются те же методы, которые используются для умягчения обычной водопроводной жидкости:
- термический (кипячение);
- реагентный – с добавлением химических веществ разного происхождения, которые при взаимодействии с солями жесткости связывают их;
- с применением фильтров (магнитные, мембранные, ионообменные, электромагнитные);
- народными способами.
Каждый вариант имеет свои особенности, преимущества и недостатки. При выборе ориентируйтесь на текущие показатели жесткости, доступный бюджет и желаемую скорость обработки воды.
Применение реагентов
Различают умягчение воды известкованием, содо-известкованием и содово-натриевый метод умягчения воды.
При известковании в раствор добавляют гашеную известь Ca(OH)2 до рН около 10. В результате протекают реакции:
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2Н2O,Mg(HCO3)2 + 2Ca(OH)2 = Mg(OH)2 + 2СaCO3 + 2Н2O.
Данный способ используют при высокой карбонатной и низкой некарбонатной жесткости воды, когда требуется одновременное снижение жесткости и щелочности. Остаточная жесткость на 0,4–0,8 мг-экв/л превышает некарбонатную жесткость.
При содо-известковании в воду добавляют гашеную известь Ca(OH)2 и соду Na2CO3 до рН около 10. В результате протекают реакции:
Ca(HCO3)2 + Ca(OH)2 + Na2CO3 = 2CaCO3+ 2NaOH + Н2СО3,Mg(HCO3)2 + 2NaOH = Mg(OH)2 + 2NaHCO3.
Как следует из уравнений реакций, в процессе образования и осаждения осадка из воды извлекаются соли жесткости. Вместе с ними удаляются коллоидные и взвешенные частицы с ассоциированными на них загрязнениями. На хлопьях осадка частично сорбируются органические загрязнения воды.
При содо-известковании за счет избытка ионов HCO3 достигается бoльшая полнота удаления из воды солей жесткости. Повышение температуры до 70–80 °С позволяет довести остаточную жесткость до 0,35–1,0 мг-экв/л. Того же результата можно достигнуть увеличением доз реагентов.
Вред, наносимый жесткой водой
Рассмотрем негативное воздействие чрезмерно жесткой воды на организм человека, бытовую технику и коммуникации. Чем выше параметр жесткости, тем сильнее будет значение каждого вида вредного воздействия.
Вред для здоровья человека и домашних питомцев
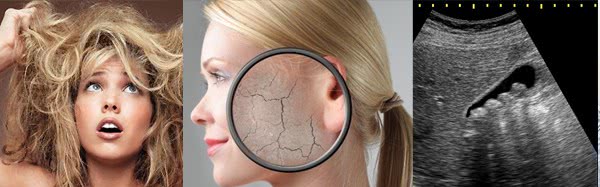
- Высокая жесткость способствует росту мочевых камней и развитию мочекаменной болезни. Это связано с накоплением солей, которые просто не успевают выводиться из организма.
- При умывании жесткая вода сушит кожу. Это происходит из-за появления «мыльных шлаков» образованных из мыла, которое не способно мылиться и растворяться в жесткой воде. Эти мыльные шлаки закупоривают поры, не давая им свободно дышать, вследствие чего могут развиваться кожные воспаления, не давать покоя зуд и жжение кожи.
- Образование тонкой корке на волосах разрушает естественную жировую пленку. Происходит это так же, как и на коже рук – «мыльные шлаки» не вымываются и постепенной накапливаются. Это может вызвать зуд кожи головы, перхоть и даже выпадение волос.
- Влияние сильно жесткой воды на здоровье животных не отличается от воздействия на человеческий организм. Существует высокий риск развития мочекаменной болезни. У питомцев, питающихся сухими кормами, этот риск возрастает в несколько раз. Возможно появление проблем с шерстью и кожей, как у собак, так и у кошек при их регулярном купании.
- Замедляется процесс приготовления пищи, из-за многочисленных солей плохо разваривается мясо. Это приводит к плохому усвоению белка и может вызвать заболевания желудочно-кишечного тракта.
Вред, наносимый жесткой водой технике и предметам быта
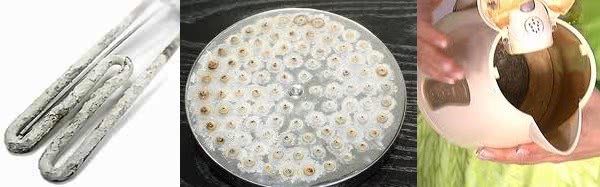
- Мыльные средства из-за наличия большого количества солей в воде крайне плохо пенятся и отмывают загрязнения. Поэтому количество порошков, средств, предназначенных для мытья посуды и прочих предметов бытовой химии, придется резко увеличить.
- Кроме плохого вспенивания мыльных средств, из-за контакта жесткой воды с ними образуются разводы и твердый налет на сантехнике и поверхности посуды, так как выпадает солевой осадок. Такой налет тяжело отмывается с посуды, а так же негативно влияет на сантехнику, постепенно разрушая ее поверхности.
- В процессе нагревания воды в электроприборах соли не просто выпадают в осадок, а кристаллизуются и выпадают в виде накипи. Именно накипь является основной причиной быстрой поломки водонагревательных приборов.
- Жесткая вода оставляет пятна, разводы и грязные налеты на свежевыстиранных вещах, цвет тускнеет, принты и рисунки становятся серыми. От них избавиться очень сложно и это, опять же, требует повышенных затрат моющих средств. Ткань, постиранная в жесткой воде, становится грубой и неэластичной, потому что соли забивают в ней все свободное пространство. Уменьшается прочность одежды и белья.
Вредные последствия воды с повышенной жесткостью для коммуникаций

- Соли жесткости так же, как и на бытовых приборах, выпадают в осадок или кристаллизуются, образуя на поверхности коммуникационных путей и крупных приборов и установок накипь. Накипь истончает стенки коммуникаций, впоследствии полностью разрушая их.
- Обилие выпадающих в осадок или накипь солей жесткости, приводит к частым выходом из строя крупных водонагревательных установок, типа бойлеров.
- В системах оборотного водоснабжения, образующиеся накипные отложения, водные камни и шлам из солей уменьшают проходимость труб, при этом падает теплоотдача. Падает напор воды, уменьшается количество воды в радиаторах, закупориваются входы и выходы воды из домов, что может привести к полному закупориванию коммуникационных сетей. Все это увеличивает энергозатраты.
Но при этом, не нужно забывать, что показатель жесткости должен равняться определенному среднему значению. Слишком мягкая вода также не несет никакой пользы. Она повышает риск развития сердечно сосудистых заболеваний у человека, вымывает соли из организма, вызывая быстрое развитие рахита и истончение костей. В коммуникационных системах мягкая вода вызывает коррозию металлических труб.
Сохраните статью в соцсети:
28 апреля 2016
Жесткость воды что это такое — практические советы по нормализации
Жесткость – это свойство воды, которое определяет ее потребительские качества и имеет важное хозяйственное значение. В процессе кипячения жесткая жидкость образует накипь на стенках и внутренних деталях нагревательных приборов, что вызывает ухудшение теплотехнических характеристик бытовой техники
В процессе кипячения жесткая жидкость образует накипь на стенках и внутренних деталях нагревательных приборов, что вызывает ухудшение теплотехнических характеристик бытовой техники.
Не особенно подходит она и для стирки, поскольку способствует снижению очищающих характеристик моющих средств и увеличивает их расход.
| Градусы dH | Характер воды | Жесткость в мг. х экв/л. | Эквивалент в mg/L |
| 23 — 34° | Очень жесткая | выше 12 мг х экв/л | 320 — 530 ppm |
| 13 — 22° | Жесткая | 8 – 12 мг х экв/л | 210 — 320 ppm |
| 9 — 12° | Средней жесткости | 4 – 8 мг х экв/л | 140 — 210 ppm |
| 5 — 8° | Мягкая | 1,5 – 4 мг х экв/л | 70 — 140 ppm |
| 0 — 4° | Очень мягкая | До 1,5 мг х экв/л | 0 — 70 ppm |
Откуда берется высокая жесткость? Ее определяет наличие солей магния и кальция – химических компонентов, выполняющих роль активных регуляторов различных химических процессов в окружающей среде. Естественно, что жидкость, которая берется из разных водоемов, может иметь ту или иную степень жесткости.
При этом река, озеро и любой другой источник пополняются из подземных источников, протекающих в известняковых пластах. Проходя через них, вода обогащается солями жесткости, а значит, будет жесткой. Для сравнения – данный показатель у поверхностных вод всегда заметно ниже, чем у подземных. Жесткость воды в природных источниках постоянно изменяется.
Максимальных отметок она достигает зимой, а минимальных – весной, во время таяния снегов.
Таким образом, жесткой является та вода, которая содержит соли магния и кальция в больших количествах. Кстати, магниевые соли растворяются хуже кальциевых, и жидкость с их высоким содержанием имеет выраженный горький вкус.
Шкала жесткости воды
Выделяются следующие виды жесткости:
- Общая – определяется как суммарная концентрация ионов магния и кальция.
- Карбонатная – зависит от наличия в воде карбонатов, гидрокарбонатов кальция и магния. Практически полностью устраняется в ходе кипячения, поэтому второе название карбонатной жесткости – временная. В процессе нагрева гидрокарбонаты распадаются – образуется угольная кислота, а карбонаты кальция, гидроксиды магния выпадают в виде осадка.
- Некарбонатная – обусловлена присутствием магниевых и кальциевых кислотных солей. При кипячении не устраняется (то есть является постоянной).
Общая жесткость измеряется в GH.
GH показывает суммарное содержание щелочноземельных металлов в виде ионов. Для примера – в воде, значение GH которой близкое к нулю, аквариумные рыбки не живут, употреблять ее в пищевых целях также не рекомендуется.
В мире для измерения показателей жесткости используются разные значения. В России Госстандарт установил следующий показатель – моль на кубический метр.
Числовое значение жесткости, которое выражается в молях на кубический метр, равняется числовому значению жесткости в миллиграмм-эквивалентах на литр.
На западе используют немецкий (d°, dH), французский (f°), американский (ppm CaCO3) градусы.
Влияние жесткости воды, нормативные требования и рекомендации
Какую воду можно употреблять для приготовления пищи и питья? Требования относительно жесткости жидкости зависят от условий конкретной местности. Учтите, что слишком жесткая вода имеет горький вкус и негативно влияет на работу органов пищеварения.
ВОЗ конкретные цифры не называет, хотя исследований на тему связи качества воды с заболеваниями сердца, сосудов и других органов организма проводились неоднократно. Слишком мягкая вода – это тоже плохо, поскольку она нарушает водно-солевой баланс.
Жидкость с жесткостью от 4 мг-экв/ чревата – главная причина образования накипи на внутренних деталях отопительных систем. Вредна она и для кожи, волос.
Жесткость – важный параметр воды, который зависит от количества и типа растворенных в ней минеральных веществ. Смягчение следует делать только после предварительного анализа. Почему? Потому что не все методы смягчения снижают содержание минеральных веществ – они могут просто превращать соли жесткости в соли, которые никак не влияют на рассматриваемый показатель.
Влияние жесткой и мягкой воды – как отличить, рекомендации

ВОЗ утверждает, что употреблять необходимо только жидкость низкой или средней жесткости с установленными границами для примесей. Не всегда водопроводный ресурс, к сожалению, соответствует этим нормативам. Негативные последствия использования воды с повышенной жесткостью приводят к:
- скорым поломкам бытовой техники – часто приходится заменять нагревательный элемент;
- неисправностям инженерных систем – стенки труб постепенно разрушаются из-за образования отложений, а также засоряются;
- испорченному здоровью;
- мелким неприятностям – например, меняется вкус еды или качество постиранных вещей (моющий состав хуже пенится), мягкость вымытых волос.
Рекомендуем не дожидаться негативного воздействия и установить мощную систему фильтрации. Также стоит использовать не водопроводную, а специально подготовленную для питья жидкость, а при стирке или во время запуска посудомоечной машины добавлять специальные средства от накипи.
Вред для человека
Если соли поступают в чрезмерном количестве, они не успевают выводиться естественным образом и скапливаются в мочевых протоках и пузыре, почках – так начинается мочекаменная болезнь.
При умывании кожа становится более сухой, может образоваться раздражение. А на волосах появляется корочка, которая препятствует их естественному увлажнению и питанию подкожным жиром. Они становятся безжизненными.
Мясо, приготовленное в водном растворе с большим содержанием кальция, хуже усваивается организмом.
Безопасность
- Перед началом опыта наденьте защитные перчатки и очки.
- Проводите эксперимент на подносе.
- Поместите горелку на пробковую подставку. Не прикасайтесь к горелке сразу после завершения опыта − подождите, пока она остынет.
- Снимите перчатки перед тем, как поджигать свечу.
Общие правила безопасности
- Не допускайте попадания химических реагентов в глаза или рот.
- Не допускайте к месту проведения экспериментов людей без защитных очков, а также маленьких детей и животных.
- Храните экспериментальный набор в месте, недоступном для детей младше 10 лет.
- Помойте или очистите всё оборудование и оснастку после использования.
- Убедитесь, что все контейнеры с реагентами плотно закрыты и хранятся по правилам после использования.
- Убедитесь, что все одноразовые контейнеры правильно утилизированы.
- Используйте только оборудование и реактивы, поставляемые в наборе или рекомендуемые текущими инструкциями.
- Если вы использовали контейнер для еды или посуду для проведения экспериментов, немедленно выбросьте их. Они больше не пригодны для хранения пищи.
Информация о первой помощи
- В случае попадания реагентов в глаза тщательно промойте глаза водой, при необходимости держа глаз открытым. Немедленно обратитесь к врачу.
- В случае проглатывания реагентов промойте рот водой, выпейте немного чистой воды. Не вызывайте рвоту. Немедленно обратитесь к врачу.
- В случае вдыхания реагентов выведите пострадавшего на свежий воздух.
- В случае контакта с кожей или ожогов промывайте поврежденную зону большим количеством воды в течение 10 минут или дольше.
- В случае сомнений немедленно обратитесь к врачу. Возьмите с собой химический реагент и контейнер от него.
- В случае травм всегда обращайтесь к врачу.
§ 68. Жесткость воды и способы ее устранения
Вода, прежде чем попасть в колодец или водопроводную сеть, просачивается сквозь почву и насыщается в ней растворимыми солями.
Природные воды содержат сульфаты и бикарбонаты кальция и магния, т.е. катионы Са2+ и Мg2+, анионы SO42- и НСО3-. Вода, в которой содержание ионов Са2+ и Mg2+ незначительно, называется мягкой, вода с повышенным содержанием их — жесткой.
При кипячении жесткой воды бикарбонаты разлагаются, образуя нерастворимые карбонаты, например:
Карбонаты осаждаются, и жесткость воды уменьшается. Жесткость, вызываемая содержанием в воде бикарбонатов кальция и магния, называется карбонатной или временной. Жесткость, обусловленная присутствием прочих солей кальция и магния и сохраняющаяся после кипячения воды, называется некарбонатной или постоянной.
Широко известно, что в жесткой воде мыло плохо мылится. Изучим это явление на опыте, взяв в качестве искусственной жесткой воды, например, раствор гипса. Нальем в бюретку разбавленный раствор мыла и будем приливать его понемногу, порция за порцией, к жесткой воде, сильно встряхивая после каждого приливания стакан с жесткой водой. Первые порции мыла будут затрачиваться на образование хлопьевидного осадка, и пены при встряхивании получаться не будет. Только после того, как прекратится образование осадка, появится пена.
Мыла — это натриевые (иногда калиевые) соли органических кислот, и их состав можно условно выразить формулой NaR или KR, где R — кислотный остаток. Анионы R- образуют с катионами кальция и магния нерастворимые соли CaR2 и MgR2. На образование этих нерастворимых солей и расходуется бесполезно мыло. Таким образом, при помощи мыльного раствора мы можем оценить общую жесткость воды, общее содержание в ней ионов кальция и магния.
Для хозяйственно-бытовых нужд требуется вода С незначительной жесткостью. При кипячении жесткой воды образуется накипь. В жесткой воде плохо развариваются мясо, овощи, крупа. При стирке тканей жесткой водой образующиеся нерастворимые соединения осаждаются на поверхности нитей и постепенно разрушают волокна.
При питании паровых котлов жесткой водой образуется накипь. Накипь затрудняет нагревание воды, вызывает увеличение расхода топлива, ускоряет изнашивание стенок котла (рис. 57).
Рис. 57. Разрез трубы водяного отопления. Просвет почти забит накипью
Для понижения жесткости воды применяют различные методы. Перед направлением в паровой котел воду предварительно нагревают, чем устраняют временную жесткость. Для питания котлов высокого давления в настоящее время часто применяют перегнанную (дистиллированную) воду. Для понижения жесткости воды используют химические методы, приводящие к переводу ионов кальция и магния в состав нерастворимых солей, обычно в карбонаты.
Карбонатную жесткость устраняют добавлением известкового молока:
Са(НСО3)2 + Са(ОН)2 = 2СаСO3↓ + 2Н2O
Некарбонатная жесткость устраняется добавкой соды:
CaSO4 + Na2CO3 = CaCO3↓ + Na2SO4
Природную воду, содержащую ионы кальция Са2+ и магния Mg2+, можно смягчить, освободить от этих ионов, заменив их, например, ионами натрия, при помощи ионообмена. Для этого воду на станциях водоочистки пропускают через ионнообменную колонку с катионитом, содержащим подвижные ионы Na+. Ионы кальция и магния удержатся в катионите, а в воду перейдет из катионита эквивалентное количество безвредных ионов натрия:
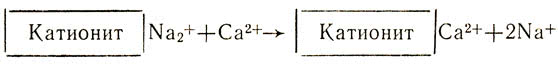
- Какая вода более жесткая: дождевая или речная? Почему?
- Объясните, почему в речной воде содержатся бикарбонаты кальция и магния.
- Как частично смягчить воду, не применяя химических реактивов?
- Напишите в ионной форме уравнения реакций, применяющихся при устранении: а) карбонатной жесткости, б) некарбонатной жесткости.
- Почему постоянную жесткость, обусловленную содержанием в воде гипса, нельзя устранить добавкой гидроокиси кальция?
- Испытайте разными способами на жесткость пробы воды, взятые из разных окрестных источников.
- * Чистую воду получают иногда не путем перегонки природной воды, а пропуская ее последовательно через две колонки, содержащие: одна — катионит, «заряженный» ионами водорода, а другая — анионит, «заряженный» ионами гидроксила. Объясните, каким образом при такой обработке вода освобождается от любых катионов и анионов и становится химически чистой.
Зачем смягчать воду
Для нашего региона характерной является проблема жесткой воды. С потребностью смягчить воду сталкиваются многие. Налет на дне чайника указывает именно на проблему с жестокостью воды.
Больше всего это проявляется при использовании артезианской воды, ведь уровень жесткости воды по большей мере определяется наличием в ней кальция и магния. Эти минералы вызывают карбонатную и временную жесткость любой воды. Смягчить жидкость с временной жесткостью можно за 1 час посредством кипячения. Карбонат осядет на дно и стенки чайника как осадок белого цвета.
В ходе этого процесса происходит выделение углекислого газа. Но если смягчить воду с временной жесткостью таким простым методом как кипячение можно, то этот метод не позволит устранить постоянную жесткость, вызванную солями таких кислот, как хлорид кальция и сульфаты. Эти соли не могут растворяться.
Статьи, рекомендуемые к прочтению:
- Виды фильтров для воды и их характеристики
- Как установить фильтр для воды — полезные советы
- Как пить воду правильно: практические рекомендации
Высокая жесткость питьевой воды придает ей горьковатый привкус, а ее употребление наносит существенный вред здоровью. Она может вызвать нарушение работы органов пищеварения. В быту такая вода может привести к поломке посудомоечной и стиральной машины, чайника или бойлера. Кроме этого, отмечено негативное воздействие на сантехнические трубы, которые засоряются и разрушаются под воздействием излишней жесткости воды
В связи с этим очень важно смягчить жесткость жидкости, и, прежде всего, снизить концентрацию магния и кальция в ней. Именно эти минералы являются причиной появления опасной накипи
Чтобы смягчить воду, можно использовать метод умягчения, опирающийся на синтетический ионообмен смолы. В его процессе смола удаляет из жидкости ионы металлов и солей жесткости, насыщая ее ионами натрия. Регенерация ионообменных фильтров, насыщенных раствором поваренной соли, вызывает обогащение смолы натрием. При этом ионы металлов и жесткость удаляются.
Для смягчения воды можно использовать специальное оборудование. При этом можно смягчить воду как для бытовых нужд, так и для промышленного производства. Если нужна непрерывная подача смягченной воды, то применяют дуплексные смягчители. Работа фильтров происходит в автоматическом режиме. Настройка процессов восстановления и умягчения тесно связана со временем и расходом воды.
СанПиН 2.1.4.1074.01 установил норматив жесткости питьевой воды не выше 7 мг на литр. При этом по жесткости воды, согласно нормам ВОЗ, оптимальные показатели составляют 1,0–2,0 мг-экв\л. Только химическое исследование может точно определить уровень жесткости. В питьевых целях можно использовать воду с жесткостью не выше 0,2 мг/л. Для нужд производства допускается применение воды с жесткостью 0,5 мг/л.
Читайте материал по теме: Умягчение воды для дома






